이번에는
"등온과정에 대한 개념과
암기 필요없이 공식 이해하는 것"을 포스팅 하겠습니다.
[이 과정에서는 단위질량에 대한 공식(양변을 질량으로 나눈 공식)을
사용하겠습니다.]
<또한 이 이론에서 사용하는 전제는 이상기체 입니다.>
※ 이번 포스팅의 소제목 내부링크
1. 등온과정
말그대로 온도 일정한 과정입니다.(△T = 0 or dT = 0)
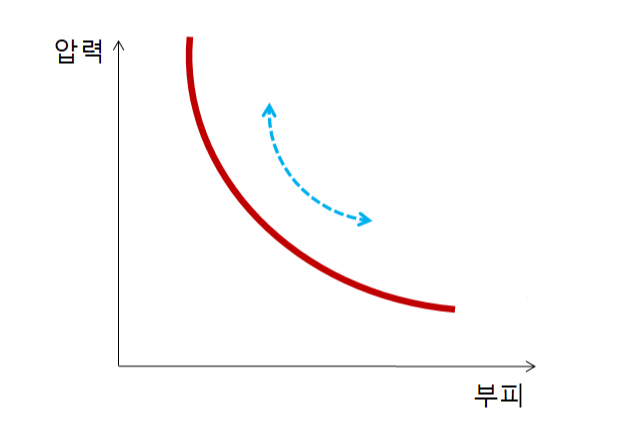
등온과정 내부에너지 계산 (u)
온도가 변화 없으므로,
온도에 대한 함수인 내부에너지(u)도 변화가 없습니다.▶ (△u = 0)
등온과정은 기체의 팽창, 압축과정으로 나뉩니다.
그래서, 팽창먼저 설명하겠습니다.
2. 등온 팽창 (v > 0 )
기체의 팽창이라 부피는 증가합니다. ▶(△v > 0)
등온과정 압력 계산 (P)
이상기체 방정식 Pv = RT에 따라,
우변에는 기체상수와 온도가 있는데,
온도가 일정합니다.
그러면 압력 x 부피 가 일정한데,(이 때, 서로 반비례관계 됨)
기체가 팽창하므로, 압력은 감소합니다. ▶ (△P < 0)
등온과정 일 계산 (w)
압력은 감소하여도, 부피는 증가합니다.
즉, 기체가 외부에 일을 해주고 있으므로(또는 그래프상 현재 오른쪽으로 진행하므로)
▶ 일(w)은 양수 입니다. (△w > 0)
여기서는 압력이 증가, 감소하냐가 구분하는 것이 아닌,
열의 출입으로 구분합니다.
등온과정 열량 계산 (q)
du = 0 고려하여, 열역학 1법칙 q = u + w 을 적용해보면
(dq = du + Pdv) → (dq = dw )
열량은 즉, 일의 변화량과 같습니다.
등온 팽창이므로, (△q = △w, q > 0)
등온과정 엔탈피 계산 (h)
엔탈피는 h = u + Pv인데
미분하면 dh = du + vdP + Pdv입니다.
그런데, 등온과정이라 온도의 변화, 내부에너지의 변화가 없습니다. (du = 0) 입니다.
따라서, dh = vdP + Pdv 가 되는데,
이 의미는 부피가 증가한 만큼, 압력은 감소한다는 의미(압력이 증가하면, 그만큼 부피 감소)이므로,
엔탈피의 변화는 존재하지 않습니다. ▶ "(△h = 0)" 입니다.
등온과정 엔트로피 계산 (s)
이전에 포스팅한 엔트로피 식 중에서

현재 등온과정이므로 위의 두 식 둘 다 사용 가능합니다.
온도변화가 없으므로, T1, T2는 존재하지 않습니다.
그래서, 두 식에서 첫번째 항(비열들어있는 항)을 제외하면 됩니다.
따라서 등온과정에서 엔트로피 식은 아래와 같습니다.

부피가 증가했으니, 당연히 엔트로피도 증가했네요,
압력은 감소했어도 앞에 음수라서 당연히 ▶ "(△s > 0)" 입니다.
여기서, 대문자 S 는 단위질량당 엔트로피가 아닌,질량을 곱한 현재 량의 엔트로피입니다.
이 때 공식이 다른 이유는 이상기체방정식 "Pv = RT"는 v가 비체적, 부피를 질량으로 나눈 값이지만,
질량으로 나누지 않는다면, PV = nRT 이기 때문 n을 고려해주어야 합니다!
3. 요약
dT = 0, △w >0, △v > 0 △u = 0, △q > 0, △h = 0, △s > 0
4. 등온압축 (v < 0 )
위 설명의 반대로 적용하면,
△w < 0, △v < 0, △u =0, △q < 0, △h = 0, △s < 0
다음에는 단열과정에 대하여 설명하겠습니다.
5. 단열과정 개념과 이해 (링크)
다음에는 단열과정에 대해 설명하겠습니다.
위와 같은 방식으로 설명하겠습니다.
링크를 참고하기 바랍니다.
앞으로도 엔지니어에게 좋은 지식과 정보를 이해하기 쉽게 글을 포스팅하겠습니다. (By. 요르문간드)
'설계지식-열&유체&엔진 > 열역학(기본)' 카테고리의 다른 글
| 기본적인 등엔트로피 개념 (0) | 2023.05.08 |
|---|---|
| 단열과정 개념이해 (0) | 2023.03.29 |
| 정적과정(등적과정) 개념 이해(각 상태량 이해) (1) | 2023.03.09 |
| 등압과정(정압과정) 개념이해(각 상태량 이해) (0) | 2023.03.08 |
| 이상기체의 엔트로피 공식과 이해 (0) | 2023.03.07 |




댓글